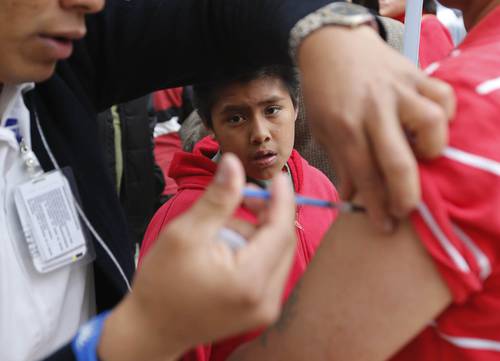
i razón de retomar la discusión sobre la(s) vacuna(s) contra el virus del papiloma humano (La Jornada, 20/8/14) fue una carta que recibí sobre el caso de una niña mexicana de 12 años. La madre habla sobre el deterioro de la adolescente, la larga búsqueda de una explicación a su condición y los múltiples estudios que le han hecho para terminar con el diagnóstico “probable” de reacción adversa a la vacuna del papiloma humano.
A raíz del artículo he recibido una carta de dos funcionarios del Centro Nacional para la Salud de la Infancia y Adolescencia, responsable de la vacunación en México, para conversar conmigo. Mi respuesta es una serie de preguntas que formulo a la Secretaría de Salud (Ssa) después de revisar la NOM -036-SSA2-2012, los lineamientos generales del programa de vacunación universal 2013, así como las fichas técnicas de Gardasil y Cervarix publicadas por la Comisión Federal contra Riesgos Sanitarios (Cofepris).
Se supone que antes de realizar una intervención médica como la vacunación, la persona debe dar su consentimiento después de haber recibido la información completa sobre efectos y riesgos. Pregunto a la Ssa: ¿cuál es la rutina de información para las vacunadas y sus familias? Ninguno de los documentos revisados da una visión clara sobre qué debe informar el personal y qué estudios médicos realizar. En particular ¿qué se informa sobre las posibles reacciones adversas? Los documentos sólo advierten como contraindicación “hipersensibilidad a cualquier componente (énfasis mío) de la vacuna”.
Las ficha de los laboratorios sobre las vacunas son más claras al explicitar hipersensibilidad al principio activo de la vacuna y al excipiente (ASO4), sustancia que puede ser la causa de las reacciones adversas. Los laboratorios recomiendan, además, una revisión de la historia clínica y un examen clínico de la persona. ¿Se hace regularmente esto a las niñas por vacunar? O es que los laboratorios se cubren contra eventuales demandas. En este contexto es de señalar que tanto Glaxo como Merck hacen referencia a los estudios limitados que han sido criticados por los investigadores.
Por otra parte, ¿se informa explícitamente a los interesados que la(s) vacuna(s) no son contra el cáncer cervicouterino y que la niña-mujer debe hacerse el Papanicolau o una prueba serológica en el futuro para detectar lesiones precancerosas o cancerosas?
Después de buscar infructuosamente en el sistema de fármacovigilancia de Cofepris, sin encontrar casos de reacciones adversas a la(s) vacuna(s) contra VPH, pregunto a la Ssa: ¿cuántos reportes de reacciones secundarias tiene?, ¿cuáles son? y ¿qué se ha hecho en cada caso? También me parece importante conocer cuántas niñas han interrumpido su vacunación. Sería sumamente útil saber por qué no han regresado a recibir la segunda o tercera dosis, ya que conocerlo puede revelar datos interesantes precisamente sobre las reacciones adversas.
Las indicaciones de aplicación de la vacuna, dadas por los laboratorios, son tres dosis con el calendario de 0-1-6 meses o 0-2-6 meses. Aunque estos intervalos están señalados en algunos documentos de la Ssa, los lineamientos generales del programa de vacunación universal 2013 determinan que la segunda dosis se aplica a los seis meses y la tercera después de 60 meses (5 años) de la dosis inicial. Mi pregunta es: ¿con base en qué investigación se cambiaron los intervalos de aplicación? y ¿se está haciendo el seguimiento sistemático de una muestra de las vacunadas para verificar los resultados?
Por último. La Ssa fundamenta explícitamente la inclusión o exclusión de intervenciones del CAUSES del Seguro Popular en el cálculo de costo/beneficio. Aunque no estoy de acuerdo con este procedimiento, pregunto: ¿cómo justificó la inclusión de una vacuna VPH cuando sólo se puede afirmar que protege contra dos o cuatro cepas del virus de las más de 100 existentes y sin poder afirmar que sea la causa del cáncer cervicouterino?
Por otra parte, es una vacuna comparativamente costosacuyo precio, según el tabulador de 2012 del CAUSES, es de 220 pesos, por dosis y en el mercado de 2 mil 500 a 4 mil pesos. En comparación, por ejemplo, la vacuna antipoliomielítica, Sabin, tiene un costo de 4 pesos en el tabulador del CAUSES. La diferencia indudablemente se debe al precio monopólico de las dos vacunas contra el VPH, debido a sus patentes.
Recuerden que el doctor Sabin, que fue decisivo para la erradicación de la polio en el mundo, nunca quiso patentar su vacuna. Su convicción era que la ciencia debería beneficiar a la humanidad, no a los negocios.
La vacuna del VPH demuestra que el motivo de lucro introduce problemas éticos y científicos que la autoridad sanitaria tiene que resolver.