|
México D.F. Domingo 3 de octubre de 2004
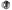 Cubrimos una gran necesidad, expresa distribuidor Cubrimos una gran necesidad, expresa distribuidor
Liberan patente de la píldora anticonceptiva
de emergencia
ANGELES CRUZ MARTINEZ
Con la patente liberada a escala mundial, la píldora
de anticoncepción de emergencia (AE) puede ser fabricada por el
laboratorio que lo desee. A casi 10 meses de haberse incluido este método
anticonceptivo en la norma oficial mexicana (NOM) sobre planificación
familiar, sólo cuatro empresas distribuyen el fármaco en
el país, una de las cuales asegura que sus ventas se triplicaron
en menos de un año.
 Jorge
Escalante Cámara, gerente regional de DNA, empresa distribuidora
de medicamentos en México, entre los que se incluye la píldora
Postinor 2, resaltó que con la AE se cubre una necesidad de la población.
Evidencia de ello es que de manera constante ha aumentado la demanda de
la también llamada píldora del día siguiente
en las farmacias. Jorge
Escalante Cámara, gerente regional de DNA, empresa distribuidora
de medicamentos en México, entre los que se incluye la píldora
Postinor 2, resaltó que con la AE se cubre una necesidad de la población.
Evidencia de ello es que de manera constante ha aumentado la demanda de
la también llamada píldora del día siguiente
en las farmacias.
Señaló que a mediados de 2003, DNA trajo
al país la AE, producida por un laboratorio húngaro que en
1999 había obtenido el registro de la Secretaría de Salud
(Ssa), sin que llegara a comercializarse en México. Un convenio
suscrito entre Gedeon Richter, con sede en Budapest, y DNA, facilitó
la introducción del producto en México.
La píldora se vendió primero en la frontera
norte con 25 mil unidades al mes. A partir de febrero de 2004, las ventas
repuntaron a las actuales 75 mil unidades mensuales, aseguró el
empresario.
Las cifras "son la mejor evidencia de que estamos cubriendo
una gran necesidad de la población", advirtió, y en seguida
rechazó las expresiones de opositores a la AE, quienes consideran
que es abortiva.
Dijo que la empresa que dirige cuenta con información
de más de 70 estudios científicos en los que se comprueba
que la píldora funciona para prevenir un embarazo y nunca para interrumpirlo.
No obstante, las reticencias hacia el producto persisten.
Un distribuidor en Tijuana, Baja California, se negó a incluir Postinor
2 en sus listas de medicamentos.
El 21 de enero de 2004, entró en vigor la actualización
de la NOM sobre planificación familiar, en la que se incorporó
la AE a los programas oficiales en la materia. En julio pasado, DNA solicitó
a la Ssa la inclusión del método en el cuadro básico
de medicamentos del sector salud. "Confiamos en que el Consejo de Salubridad
General analice el caso con la prontitud que lo hizo con Viagra", subrayó.
Aunque la principal indicación de Viagra es el
tratamiento de la disfunción eréctil, su entrada en el cuadro
básico fue bajo la consideración de su utilidad terapéutica
para el control de afecciones cardiacas.
Al referirse a la aún escasa oferta de la AE por
los laboratorios, Escalante mencionó que sólo existe una
marca que se fabrica en el país. Las tres restantes provienen del
exterior. Aclaró que DNA únicamente distribuye Postinor 2
y que no mantiene relación comercial con los fabricantes franceses
de la marca Vika, aunque admitió que hubo un intento fallido de
entablar un acuerdo de comercialización de este producto.
Tras la liberación mundial de la patente es factible
que en unos cuatro años se empiece a observar el incremento en el
número de presentaciones de la píldora.
Lo más importante entonces será, advirtió,
que las autoridades vigilen su calidad. La presentación de dos pastillas
con 0.75 miligramos de la progestina levonorgestrel garantiza que la mujer
prácticamente no sufra efectos secundarios. Ello depende en gran
medida de las materias primas que se utilizan en su elaboración,
indicó.
|






 Jorge
Escalante Cámara, gerente regional de DNA, empresa distribuidora
de medicamentos en México, entre los que se incluye la píldora
Postinor 2, resaltó que con la AE se cubre una necesidad de la población.
Evidencia de ello es que de manera constante ha aumentado la demanda de
la también llamada píldora del día siguiente
en las farmacias.
Jorge
Escalante Cámara, gerente regional de DNA, empresa distribuidora
de medicamentos en México, entre los que se incluye la píldora
Postinor 2, resaltó que con la AE se cubre una necesidad de la población.
Evidencia de ello es que de manera constante ha aumentado la demanda de
la también llamada píldora del día siguiente
en las farmacias.
